在癌症发展的过程中,原发性肿瘤细胞可能通过血液或淋巴系统迁移到身体其他部位形成新的肿瘤,即继发性肿瘤(转移瘤)。相较于原发性肿瘤,继发性肿瘤基因突变高度保守,可塑性显著增强,可适应多种生存环境,并对现有的包括化疗、靶向治疗和免疫治疗在内的全身治疗方法产生抗性,最终导致患者死亡。
结直肠癌(CRC)是全球第二大癌症死亡原因,约有 20-50% 的局部结直肠癌患者在初始治疗后进展为 IV 期转移性疾病,并有约 30-40% 的患者在接受原发性肿瘤切除手术后出现了转移。常用 CRC 研究模型中,体外肿瘤细胞系缺乏亲本的病理学特征和异质性;动物模型成本高、通量低、差异性大;而来源于患者肿瘤组织的类器官则因保留有原始肿瘤的遗传和形态特征以及结构功能备受研究者青睐。2020 年 9 月,复旦大学团队首次培养出 CRC 肝转移的类器官模型(参考资料 [2]);2022 年 9 月,基于 CRC 肝转移的类器官生物库也已经构建(参考资料 [3])。
2024 年 10 月 30 日,美国斯隆-凯特琳癌症中心 Dana Pe’er 及 Karuna Ganesh 团队在期刊 Nature 发文 “Progressive plasticity during colorectal cancer metastasis”。
本研究使用来自同一患者的三种组织样本,发现继发性肿瘤耗尽肠干细胞 ISC,走向复杂的非典型基因表达,并因此拥有更强的可塑性。此外,使用类器官模型,研究团队检测出可实现阻遏转移表型发展的重要因子 PROX1,为 CRC 转移瘤的病理机制研究与临床治疗提供了新线索。

(来源:参考资料 [1])
分子特征鉴定
临床上,应对结直肠癌常采用同期切除手术,将正常肿瘤、原发性肿瘤和继发性肿瘤(常见转移灶为肝脏)一同切除。研究团队继而观测到,这三种组织涵盖了肿瘤从发生到转移的全过程,可作为机理探索的良好样本组,因此首先采用单细胞 RNA-seq,对来自同一患者的三种组织样本间的差异性特征进行了鉴定。
ISC 水平与基因特异性表达区别
主成分分析 PCA 显示,三种样本间最大的差别来自于 LGR5+ 肠干细胞 ISC 特征。
在正常组织中,ISC 会在保持自我更新的同时分化生成多种子细胞,包括肠内分泌细胞、潘氏细胞、杯状细胞等分泌谱系,以及负责吸收的肠道上皮细胞等。与此同时,ISC 也被广泛认为是大部分结直肠癌的起源细胞。研究人员发现,相对于正常分化的结肠组织而言,肿瘤细胞表达更高水平的 ISC,反应肿瘤组织拥有更强的潜在分化能力。
而将肿瘤细胞与正常组织中的 ISC 进行对比,则发现了更细分的基因表达上调,包括 WNT 信号传导基因(LGR5、EPHB2、ASCL2、TCF7)、胚胎发育基因(BMP7、SOX4、CYP2W1)和应激反应基因(UPR1、MTORC1)等。
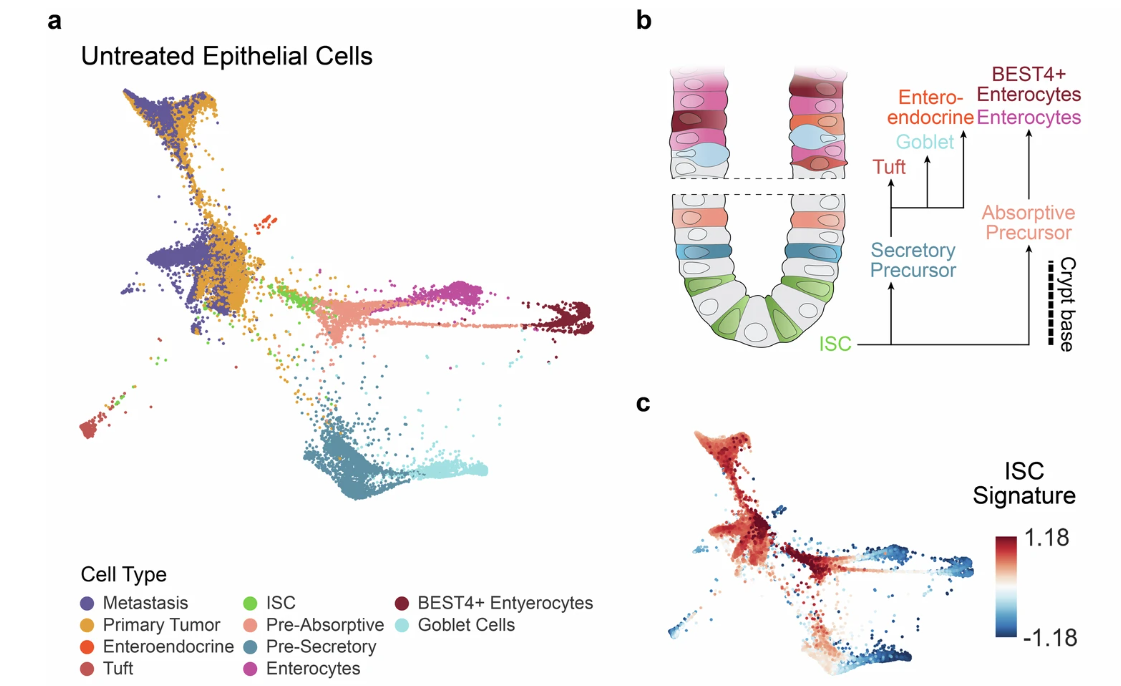
图1:不同组织样本中 ISC 水平的差距
(来源:参考资料 [1])
在肿瘤细胞内部,继发性肿瘤则表现出了比原代肿瘤更低的 ISC 水平;其间,接受过化疗的继发性肿瘤 ISC 水平最低。未经治疗的原发性肿瘤的转移过程理论上伴随 ISC 的分化,因此在转移性肿瘤中,ISC 样细胞最终被耗尽。
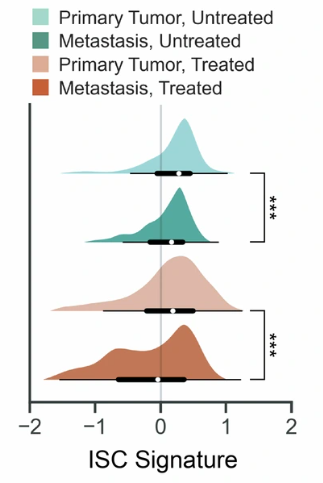
图2:所有肿瘤细胞中 ISC 水平
(来源:参考资料 [1])
整体而言,正常肠道细胞根据细胞类型的不同严格表达特异性基因。而肿瘤细胞的内部细胞特征混乱,可能在同一个细胞中共表达吸收、分泌以及 ISC 特异性基因。这种大批量混杂的谱系特征也反馈出肿瘤细胞内肠道生理层次的失调和肿瘤特异性程序的获得,与其他癌症中的结果保持一致。
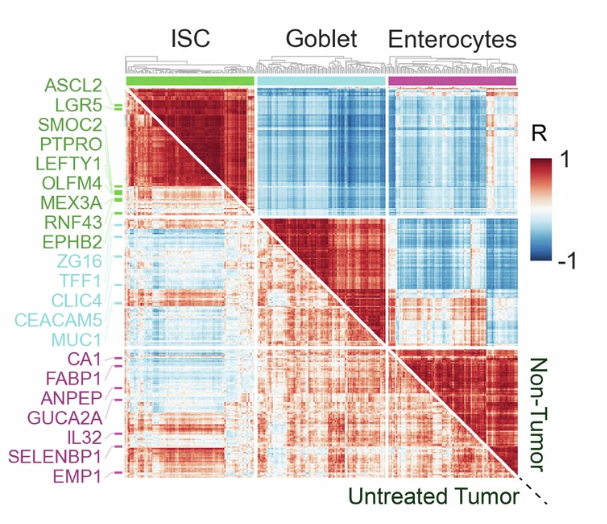
图3:正常肠细胞(上对角线)和未经化疗的肿瘤(下对角线)中的基因-基因相关性
(来源:参考资料 [1])
转移瘤丧失经典肠道谱系身份,非经典模组表达增加
在初步鉴定三种样本内部基因表达的差异之后,研究人员使用 Hotspot 对肿瘤细胞进行注释,将鉴定得到的 37 个基因程序归类为 10 个模组。其中包含 4 个正常肠道细胞可能会表达的典型基因模组,分别是 ISC 样(LGR5,ASCL2),分化后的吸收(FABP2,KRT20)和分泌(TFF3,TFF1)型肠道细胞表型;
以及另外 6 个非典型的基因表达模组。其中,损伤修复模组(L1CAM,EMP1,TACSTD2、CD70和OSMR)与肿瘤再生以及转移瘤的治疗抗性紧密相关。L1CAM 在早前报道中已被确认为结直肠癌转移起始细胞的标志物。
另外两个模组与损伤修复紧密相关,其中一个表达上皮间质转化 EMT / 胆管上皮细胞标志物(CDH2, Vim),一个表达内胚层发育基因(WNT5B, BMP4)。
值得注意的是,有 3 个模组表达与分化的非肠道细胞状态相关的基因,它们分别表达鳞状细胞样(KRT5, ELF5)、神经内分泌细胞样(NEUROD1, CHGB)和成骨细胞样(MSX1, DLX5)谱系。尽管正常结肠组织中也会含有一定量的肠内分泌细胞,但比之肿瘤细胞,其缺少肠转录因子 CDX1 和 CDX2 ,且其丰度远不如肿瘤细胞富集。另外,在本次受试的 CRC 患者中,鳞状样和神经内分泌样模组普遍存在,水平不同。
整体看来,肿瘤细胞中,肿瘤 ISC 样、损伤修复、 EMT 和内胚层模组倾向于组合共表达;如吸收等分化度更高的模组则倾向于细胞特异性表达。这也显示出肿瘤细胞内部的失序,与其保留有的部分正常分化细胞的严格基因表达的特质。
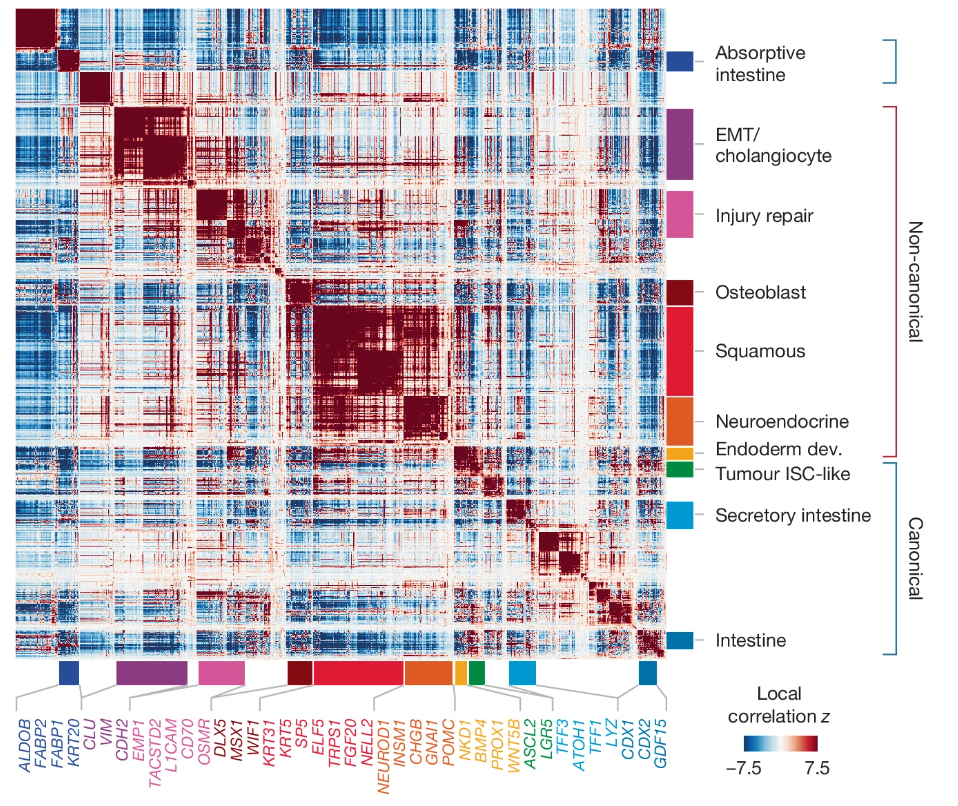
图4:所有 CRC 肿瘤细胞的基因注释结果
(来源:参考资料 [1])
关注到原发性肿瘤细胞在转移过程中失去肠谱系身份、转化为非典型身份的重要性,研究团队其后使用多重免疫荧光分析将细胞可视化,并在蛋白质水平上对相关标记物进行了检验。
结果显示,原发性肿瘤仍然保留有限定转录因子 CDX2 这一肠谱系特征的表达;而转移瘤中,分化相关肠标志物 CK20 及 ISC 标志物 OLFM4 下调,损伤修复标志物 TR0P2 中幅度上调,再度印证了其肠谱系身份的丧失。
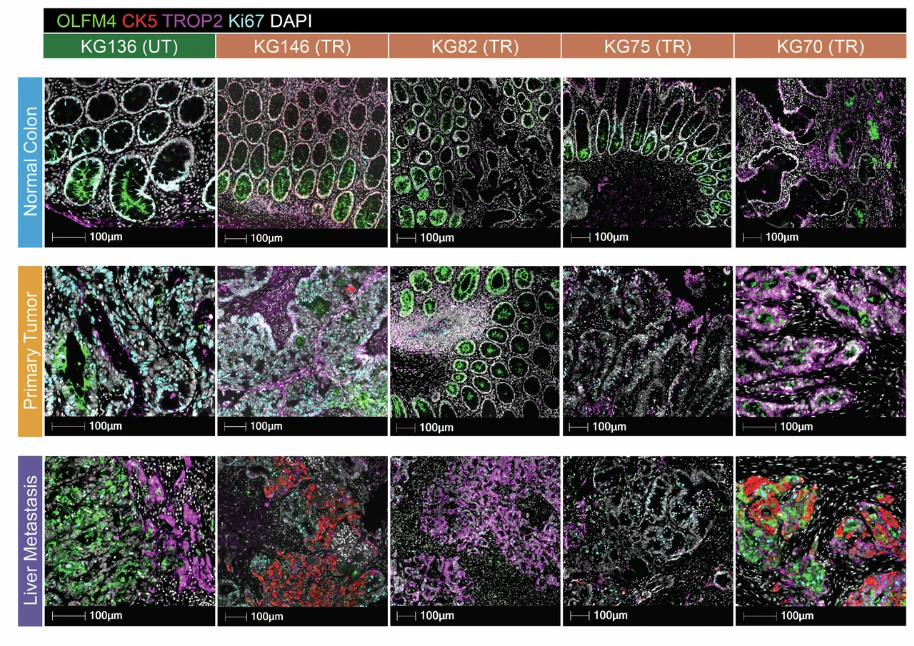
图5:三种组织样本中,典型与非典型标志物的免疫荧光染色结果
(来源:参考资料 [1])
此外,相较于原发性肿瘤,转移瘤中非典型表达细胞占比更高。这一结果在此前研究中也得到了验证。此外,鳞状样和神经内分泌样等非典型基因表达也在未经治疗的患者中检出,指示治疗并非进入非典型状态的先决条件。不过化疗可能影响转移瘤中非典型模组的表达水平。
总而言之,相较于正常组织,肿瘤细胞拥有更高的 ISC 表达水平以及更混乱的共表达谱系。肿瘤细胞当中,继发性肿瘤失去肠谱系身份,产生更多的非典型基因表达,过程中 ISC 特征被耗尽。
典型到非典型模组的转变轨迹
胎儿祖细胞是转移的中间状态
接下来,研究人员试图解码从原发性肿瘤到继发性肿瘤,典型模组到非典型模组的演变轨迹。此先进行基因注释时,研究团队已经注意到,内胚层发育模组似乎处在两种基因表达路线的中间地带。理论上而言,更原始的发育状态应该与肿瘤生物学有密切关联。研究人员从胎儿发育数据集出发,试图系统表征内胚层状态,并鉴别了 113 个在胎儿祖细胞中,与 ISC、成熟结肠细胞差异性表达的肠道胎儿特征。将此标记沿肿瘤进展轴绘制,发现其标志着典型与非典型基因表达状态之间的明确中间态,即典型基因模组去分化为内胚层发育模组,再度进入非典型模组。
因此整体的迁移路线为,正常组织中的 ISC 异常生成原发性肿瘤,继而去分化为 ISC 样细胞、胎儿祖细胞,最后启动转移侵袭成为继发性肿瘤。
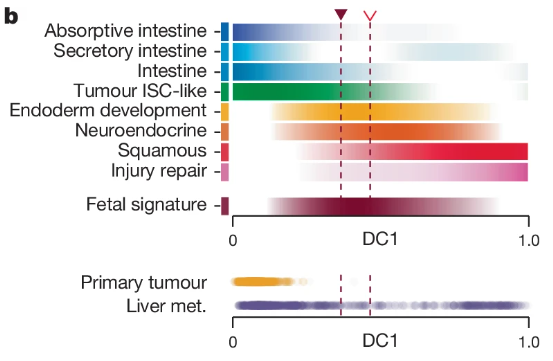
图6:所有肿瘤细胞中沿着扩散分量 DC1 的基因模组评分趋势
(来源:参考资料 [1])
WNT 信号在非典型模组中上调
在多个患者的肿瘤样本内,研究人员观测到包括 WNT 基因(TCF7、PTK 7)在内,一系列人类肠道胎儿祖细胞标记基因的普遍高度上调,由此推论这些基因可能是转向非典型命运的调控者。除此以外,通过 Hotspot 伪排序分析,研究人员发现,在去分化丧失肠谱系身份的同时,与 WNT 相关的早期发育程序也有所上调。且在 Palantir 轨迹分析中,鳞状样和神经内分泌样分支内 WNT 信号基因也均有上调。
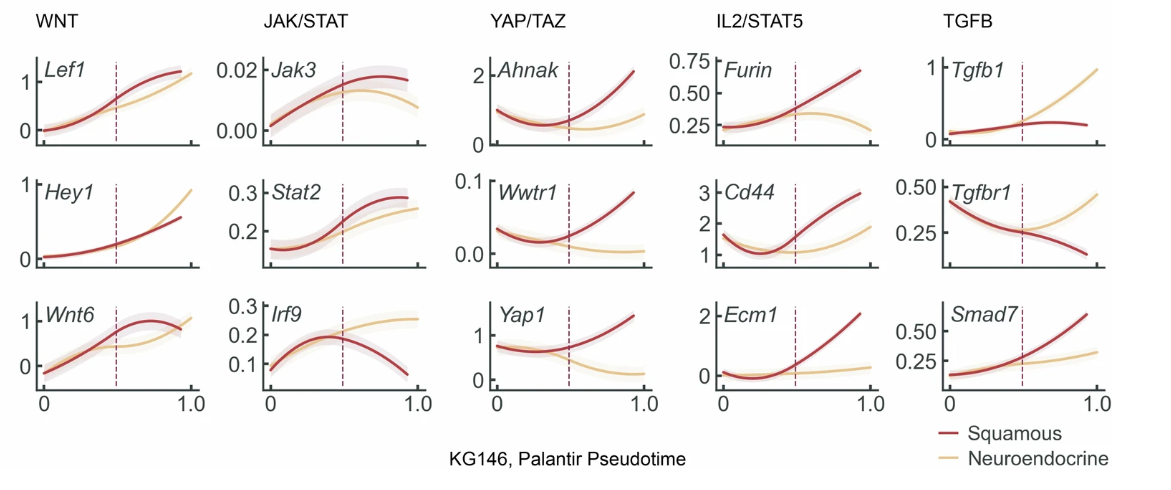
图7:单一患者的 Palantir 轨迹分析
(来源:参考资料 [1])
WNT 蛋白是一类富含半胱氨酸残基的分泌型糖蛋白,可通过自分泌和旁分泌方式介导信号传导,从而调节细胞增殖、分化和凋亡等多个过程。在首例类器官培养中,WNT 即被作为关键信号通路因子加入培养基促进类器官生长。而在 CRC 中,异常的 WNT 信号传导可能促进异常的 ISC 增殖并启动肿瘤发生。而 LGR5 编码 G 蛋白偶联受体样糖蛋白激素受体,可结合配体 R-spondin (RSPO) 1-4 蛋白,放大典型的 WNT/β-catenin 信号传导,并催化 ISC 自我更新,因此已经成为一种潜在的肿瘤靶标。
WNT 在类器官和肿瘤生长中的重要作用肯定了类器官模型用于肿瘤研究的贴合度与巨大潜力。
利用类器官重构转移瘤模型
ISC 可能抑制非典型基因表达
为了确认非典型模组路线的起始是肿瘤细胞的自主变化,亦或是受结肠与转移微环境间的差异驱动,研究团队引入两个类器官模型,分别是 KG146 原发性肿瘤类器官(OKG146P)和肝脏转移瘤类器官(OKG146Li)。前者被视作为典型表达模组,后者涵盖有从典型到非典型的完整谱系。
当使用 ISC 培养基培养类器官并添加 ISC 相关生态位维持因子时,OKG146P 保留了很大程度的 ISC 样肿瘤细胞。而 OKG146Li 在 ISC 样细胞之外,还保留有内胚层祖细胞,非典型基因表达很少,这与直接分离的转移瘤组织特征不相符。
研究人员考虑到原发性肿瘤的高 ISC 水平以及低非典型模组表达这一双面性,认为 ISC 培养基与生态位维持因子可能助长了 OKG146Li 中 ISC 水平的保留,并同步抑制了非典型基因表达。
研究人员随后在 ISC 培养基上去除了 ISC 生态位维持因子,并尝试将类器官更换到无肠道生长因子的培养基中,结果发现,OKG146Li 中的 ISC 标志物 LGR5 表达均有降低,非典型模组标志物表达上调。这种变化确认了 ISC 相关生长因子具有抑制非典型基因表达的能力,也反映出转移瘤具有响应不同环境信号的强大可塑性。
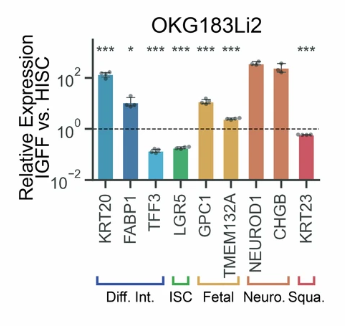
图8:转移瘤类器官中的基因表达水平
(来源:参考资料 [1])
转移瘤类器官在移植后保留非典型基因表达能力
为了确认转移瘤类器官模型适应结肠和肝脏不同微环境的可塑性是否在体内保留,将其经异种移植到具有高度免疫缺陷的 NGS 小鼠模型内。
实验发现,原发和继发肿瘤在肿瘤发生的原位(即盲肠)中的生长模式相近;在转移后的地区(肝脏)内,只有继发性肿瘤生长。多重免疫荧光分析也发现,OKG146Li 衍生的异种移植物保留分化成所有典型和非典型状态的能力,与患者体内的肝转移类似。
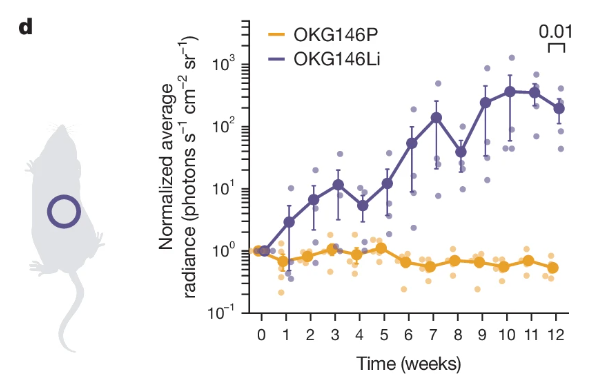
图9:小鼠肝内注射类器官后
(来源:参考资料 [1])
PROX1抑制向非典型模组的转化
研究人员假设,在中间态的胎儿祖细胞中,存在一种转录因子拥有抑制其向非典型命运转化的能力。经过筛选,发现多效性 homeobox 转录因子 PROX1 拥有和非典型模组同步上调的最强同步性,并与典型模组的下调呈负相关趋势。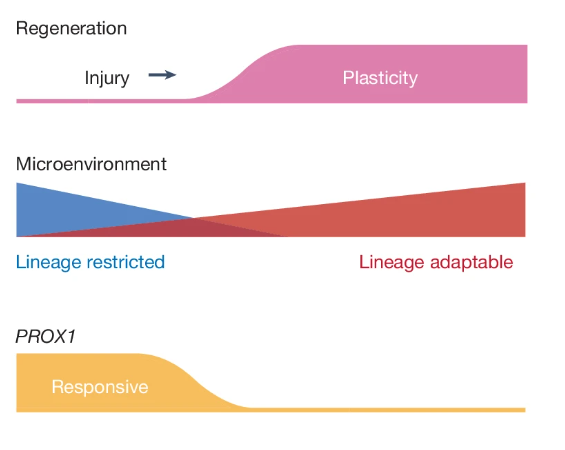
图10:PROX1 在肿瘤转移抑制中的作用机理
(来源:参考资料 [1])
在正常生理环境下,当肠道上皮细胞受损时,高度保守的转录调节因子 PROX1 会在再生细胞中表达,并参与再分化成为典型肠道状态的修复过程。
使用基因工程敲低 PROX1 表达后,原发性肿瘤 OKG146P 类器官突破相关限制,非典型基因大量表达;向非典型状态演进的继发性肿瘤 OKG146Li 类器官 则受该诱导影响较小。但是,PROX1 敲低并不足以引起移植 OKG146P 的小鼠发生肝脏转移,暗示存在有其他表型驱动因子尚未鉴别。
考虑到类器官的形成与 ISC 状态类似,都需要从干性细胞重分化为多细胞类型,研究人员假定,当 PROX1 敲低后,从 RNA-seq 得到的单细胞会倾向于非典型基因表达而更难以进入 ISC 状态,并因此形成更少的类器官。实验结果表明,PROX1 与 ISC 的依赖关系取决于细胞状态背景:具有典型细胞状态的细胞系(OKG136P、OKG136Li、OKG173Li和OKG146P)在 PROX1 敲低后形成更少的类器官,而非典型细胞系(OKG146Li、OKG182CW2和OKG183Li2)则不受 PROX1 敲低的影响。
这也意味着 PROX1 对非典型基因表达和肿瘤转移的限制性具有背景特性依赖,在转移瘤或接受化疗之后,更多的谱系不再受 PROX1 的限制,具有高度可塑性。
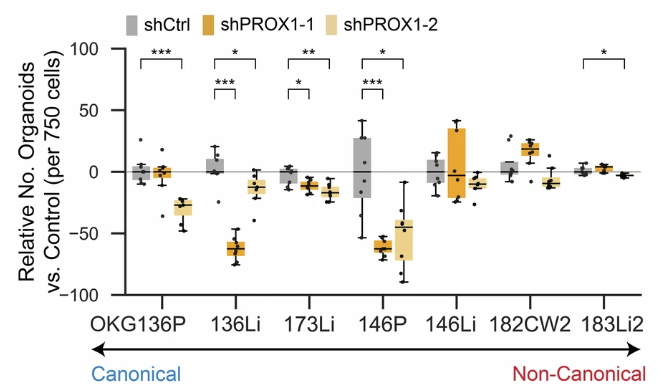
图11:靶向 PROX1的类器官与对照组类器官生长情况对比
(来源:参考资料 [1])
总结与展望
在现代医学中,转移性癌症的治疗一直是一个重大挑战。本研究通过分析来自正常结肠、原发性和转移性结直肠癌的三重标本,揭示了肿瘤转移的演进路径。
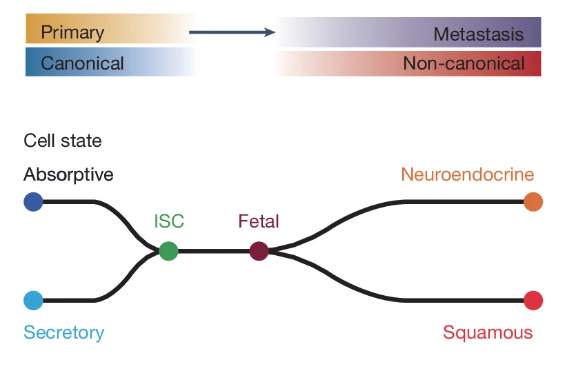
图12:转移瘤发展过程中细胞状态的转变
(来源:参考资料 [1])
研究发现,正常的分化细胞首先会去分化成 LGR+ ISC 样状态,而后肿瘤侵袭前沿的细胞经历发育逆转成胎儿祖细胞样状态,从而进一步重编程为鳞状细胞样、神经内分泌样等非典型状态以适应不同的环境压力。该非典型表达模组在转移性生长期间富集,并可被 ISC 相关生物环境维持因子所抑制,往往指向不良预后结果,可作为临床生物标志物使用。
此外,依托类器官模型,研究人员提炼出可能的非典型模组抑制分子 PROX1,不过 PROX1 也可能因此增强 ISC 样状态并在早期肿瘤发生中促进原发性肿瘤的生长。PROX1 参与上皮损伤修复步骤,而现阶段的化疗可能引起上皮损伤并促进肿瘤转移。本文提出的新思路,有望对继发性肿瘤根治提供另一种可能。
作者提到,与 PROX1 拮抗并驱动 CRC 转移的其他因子还有待于阐明,且来自于转移性肿瘤的类器官受限于穿刺获得样本的难度较高,培养成功率低等阻碍,依旧存在有一定桎梏,需要进一步的研究与优化。
参考资料
1. Moorman, A R et al. “Progressive plasticity during colorectal cancer metastasis.” Nature, 10.1038/s41586-024-08150-0. 30 Oct. 2024, doi:10.1038/s41586-024-08150-0
2. Li, He et al. “Modeling tumor development and metastasis using paired organoids derived from patients with colorectal cancer liver metastases.” Journal of hematology & oncology vol. 13,1 119. 3 Sep. 2020, doi:10.1186/s13045-020-00957-4
3. Mo, Shaobo et al. “Patient-Derived Organoids from Colorectal Cancer with Paired Liver Metastasis Reveal Tumor Heterogeneity and Predict Response to Chemotherapy.” Advanced science (Weinheim, Baden-Wurttemberg, Germany) vol. 9,31 (2022): e2204097. doi:10.1002/advs.202204097
